서론
가와사키병(Kawasaki disease, KD)은 소아 연령에서 발생하는 전신적인 염증 발열 질환으로서 해열제나 항생제에 반응하지 않는 발열, 비전형적인 피부발진, 림프절 종대, 구강의 변화, 분비물이 없는 결막 충혈, 상지 또는 하지 말단의 변화와 같은 임상 증상으로 진단한다[1]. KD는 자기국한적 질환(self-limited disease)이지만, 치료하지 않을 경우 동맥염이 발생하고 생명과 연관성이 있는 관상동맥의 심각한 변화를 가지고 온다[2,3]. KD의 원인은 아직 밝혀지지 않았으나, 면역학적 기전에 의하여 질환이 발생하고, 이를 근거로 면역조절요법을 시행하며 관상동맥의 병변을 추적 관찰하면서 치료하게 된다[2-4].
KD은 주로 동양에서 서양보다 많이 발생하며[5], 대부분 5세 이하의 소아연령에서 진단되어 유전적 배경과 면역계의 성숙도와 밀접한 연관성이 있다고 생각된다[6,7]. KD의 발생에 대한 유전적 접근을 통하여 FcγR2a(FCGR2A), Caspase 3(CASP3), HLA class II, BLK, Inositol-triphosphate 3 kinase C(ITPKC), CD40의 유전자의 다형성과 밀접한 관련이 있다고 알려져 있다[4,6,8]. TGF-β 신호전달과정의 유전자 변형은 관상동맥류와 연관성이 있다[8]. FCGR2A 는 면역글로불린 γ Fc 수용체와 연관된 유전자로 유럽에서 KD 발생과 밀접하게 관련이 있고, CASP3는 면역세포의 세포자멸사(apoptosis), T세포의 분화 및 활성화에 관여하는 효소, BLK는 B세포 수용체를 통한 신호전달과 연관된 tyrosine kinase, CD40은 TNF 수용체 등을 부호화하는 유전자로서 KD가 잘 발생할 수 있거나, 관상동맥의 병변과 밀접한 관계를 하는 것으로 알려져 있다[2-4,8]. KD와 연관된 유전자들은 모두 면역반응에서 중요한 역할을 하기에 KD 발병과 혈관병변은 면역반응에 의하여 나타난다.
본론
아직 KD를 유발하는 근본적인 원인은 알 수 없으나, KD는 과도한 사이토카인(cytokine)으로 인한 염증반응으로 알려져 있다. 급성기에 호중구의 증가와 interleukin-1(IL-1)이나 IL-6 및 TNF의 신호전달의 활성화를 보이는 선천면역(innate immunity)이 관여한다[4,8,9]. 이러한 선천면역과 함께 적응면역반응(adaptive immune reaction)으로 Th1/Th2 세포 비율의 불균형으로 발생하며[10], IL-17이 증가하여 Th17 세포와 조절 T 세포의 비율의 변화되고 이는 정맥 면역 글로불린(intravenous immunoglobulin, IVIG)을 투여하면서 조절 T 세포가 증가하는 현상이 나타난다[11]. IVIG를 투여하여도 반응하지 않는 경우 Th17 세포가 지속적으로 증가되는 양상을 보인다[11,12].
KD는 발열이 있은 후 2주를 전후하여 3단계의 과정이 나타나는데 괴사성 동맥염(necrotizing arteritis), 아급성 만성동맥염(subacute chronic arteritis), 혈관 내 근육섬유모세포 증식(luminal myofibroblastic proliferation)이다. 괴사성 동맥염은 동맥벽에 호중구가 침윤되면서 혈관의 내피, 중피 및 외피의 점진적인 괴사가 일어나는 과정이다. 아급성 만성동맥염은 발열이 있은 이후 2주 후에 동맥에 림프구, 형질세포 및 호산구가 침윤되고 혈관 외피에서 혈관 내로 진행되는 양상을 보인다. 혈관 내 근육섬유모세포 증식은 평활근 세포에서 유래된 근육섬유모세포와 기질(matrix)가 나타나면서 혈관 내를 점차 폐쇄시키는 양상을 보인다[2,4].
KD의 동물 모델에서 Lactobacillus caseii cell wall extract(LCWE), Candida albicans water soluble fraction(CAWS), FK565 등으로 KD와 유사한 양상을 보이는 관상동맥염을 유발하여, 발병 기전과 동맥염 연구를 하고 있다. 이러한 유발 물질들은 선천면역과 적응면역에 관여하는 세포들의 침윤과 활성도를 확인할 수 있다[13,14]. 최근 KD의 급성기에 IL-1 신호전달이 관여하는 동물 및 사람의 결과가 알려지게 되면서 발열을 유발하는 전염증 물질인 IL-1과 연관된 선천면역이 KD의 발생 기전와 밀접한 관련성이 부각되게 되었고, 이를 토대로 치료에 적응하려는 임상연구가 시작되었다[15-18].
선천면역은 적응면역과 달리 해가 될 수 있는 물질에 처음으로 인체에서 반응하는 면역기전이다. 적응면역은 선천면역을 통하여 항원제시세포가 항원을 처리하여 제시함으로써 특정 항원에 반응하는 면역기전이다. 선천면역에서 해가 될 수 있는 물질을 인지하는 것은 패턴인식수용체(pattern recognition receptor, PRR)로 이루어지며 이는 병원체 등에서 유래된 병원체-연관 분자패턴(pathogen-associated molecular pattern, PAMP)과 손상-연관 분자패턴(damage-associated molecular pattern, DMAP)을 인지하여 선천면역이 시작된다[19,20]. PAMP에는 lipopolysaccharide, flagellin, 바이러스의 single stranded RNA나 double stranded DNA 등이 있으며, DAMP에는 heat shock protein, HMGB1(high mobility group box 1), S100 protein, uric acid 등이 있다[19,21,22]. 이러한 PRR은 세포막에 있는 막통과 단백(transmembrane protein)으로 Toll-like receptors(TLRs)나 C-type lectin receptor가 있고, 세포질 내에 있는 RIG-I-like receptor(RLR), AIM2-like receptor(ALR)과 nucleotide-binding domain and leucine-rich repeat-containing(NLR) 단백으로 되어 있다[19,20].
DAMP나 PAMP에 대하여 PRR은 세포 내 신호전달을 활성화시키는데, NLR 등과 관련하여 세포질 내 단백 복합체를 형성하며 이를 염증조절복합체(inflammasome)라고 하며, 이를 통하여 전염증성(pro-inflammatory) caspase 1과 11을 활성화시킨다(Fig. 1)[22,23]. 이러한 과정에서 procaspase가 caspase를 활성화시키면서 IL-1β와 IL-18을 생성하고 세포의 죽음(pyroptosis)을 유도하게 된다[22,23]. Pyroptosis는 세포질 부종과 형질막의 파열을 보이면서 caspase과 무관한 괴사성 세포죽음의 양상을 보인다. Caspase 1은 IL-1β와 IL-18을 생성하게 되며, IL-1β는 Th1, Th17 등의 적응면역반응을 유도하는 발열 사이토카인으로서, IL-18은 Th17 세포에서 IL17의 발현을 증가시키고 Th1이나 Th2 세포로 분극시킨다(polarization)[22,23]. NLR 중에서 Nrlp3 inflammasome 활성화가 선천면역에서 많이 연구되고 있으며, 이는 세포 내 K+의 유입, 미토콘드리아의 이동, 미토콘드리아의 활성산소 생성, 리소솜의 cathepsin의 세포질내 방출 등으로 활성화된다[22-24]. 선천면역반응을 통하여 IL-1과 IL-18 등이 분비되면서 발열과 함께 적응면역반응 등이 시작되며, 호중구 등의 활성화가 일어나게 된다.
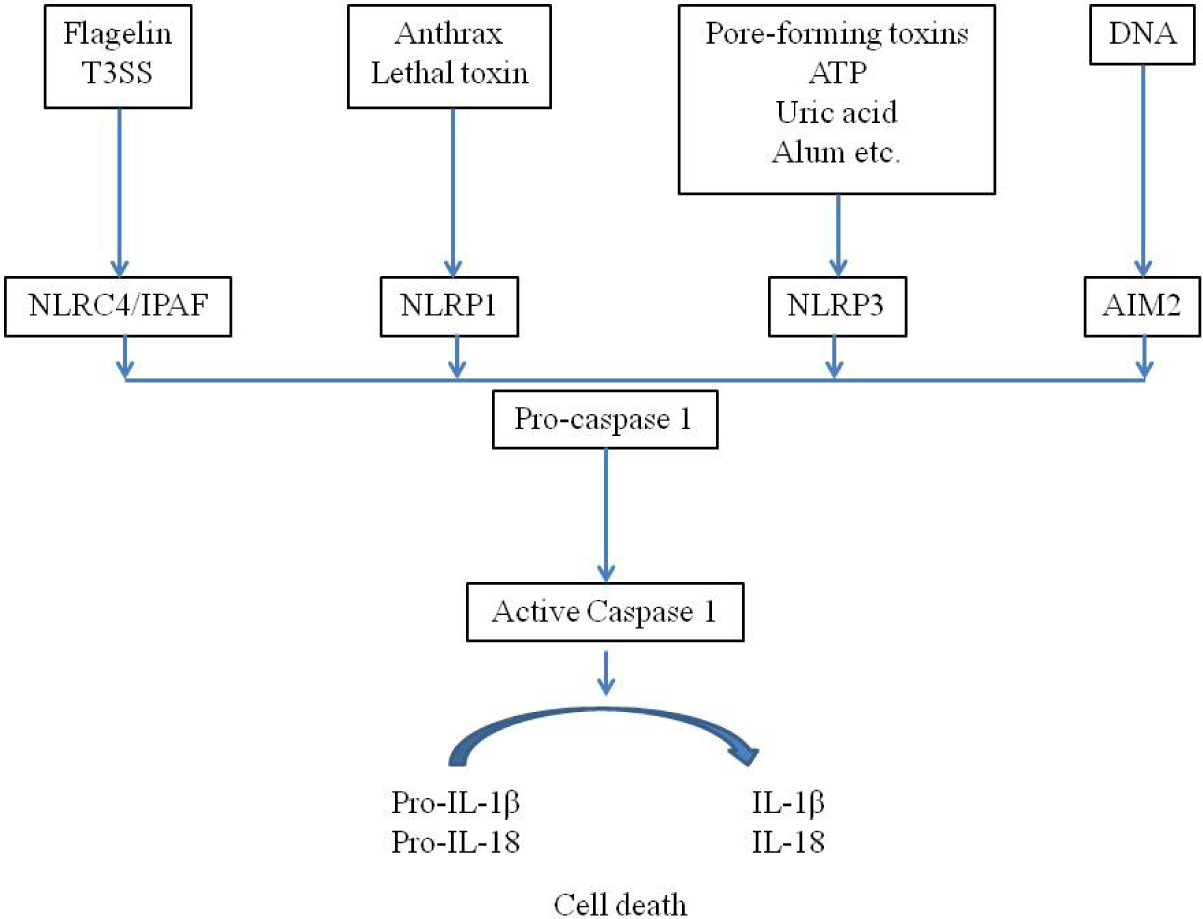
Inflammasome은 세포 내에서 PRR의 작용으로 구성되어 IL-1과 IL-18을 분비하면서, 발열과 함께 다양한 사이토카인의 분비와 적응면역반응을 유도하면서 혈관에서 염증을 유발한다[25]. 혈관염을 보이는 자가염증질환인 베체트병(Behcet’s disease)에서도 Nlrp3 inflammasome의 발현이 현저하게 증가되어 IL-1β의 분비로 인하여 피부병변과 전신적인 염증이 일어난다[26]. 또한, IL-1의 다형태(polymorphism)와 혈관염에 관한 메타분석에서 아시아 사람들에서 베체트병과 함께 KD와 연관성이 높았다. KD 환자에서 IVIG에 저항을 보이는 환자에서 IL-1과 연관된 유전자와 MMP-8(matrix metalloproteinase 8)에 대한 전사물질이 가장 높았다[28]. KD과 연관된 ITPKC 유전자도 inflammasome의 활성화에 관여하며 이는 치료 반응과도 연관성이 있다[29]. 동물실험에서 LCWE가 관상동맥의 내피세포에서 Nlrp3 inflammasome을 형성하게 되고 이를 통하여 caspase1이 활성화되어 IL-1β를 분비하고 관상동맥의 병변을 유발한다[16,30].
HMGB1은 선천면역에서 DAMP로써 모든 유핵 세포에 존재하는 25KD의 histone이 없는 핵단백으로서 세포의 이동이나 사이토카인 생성 등의 역할을 한다[31]. KD 환자에서 HMGB1이 현저하게 증가되어 있으며 IVIG에 저항성을 보이는 환자에서 특히 높고[32,33], 이에 대한 수용체인 Receptor for advanced glycation end(RACE)는 관상동맥 병변이 있는 환자에서 높아 KD 환자에서 IVIG의 저항성 및 관상동맥 병변을 예측할 수 있다[34].
결론
KD는 소아에서 관상동맥염을 포함한 후천적인 심장질환을 유발하는 급성 열성질환이다[4]. 아직 원인은 밝혀지지 않았으나, 과도한 면역반응으로 인한 질환이며, 이에 준하여 면역조절요법이 시행되고 있다[4,18]. KD는 적응면역반응보다는 선천면역반응의 결과로 시작되며[13,14], 최근 이러한 근거가 동물실험과 사람에서 나오고 있다[16,29,30]. IVIG 치료에 반응하지 않는 환자들에서 다양한 면역조절요법을 시행하고 있으나[2,18], 선천면역기전에 준하는 새로운 임상연구가 진행되고 있다[17]. 이에 따라 KD에 관심을 갖고 있는 많은 소아과 의사들에게 선천면역에 대한 보다 깊은 연구와 지식이 필요하다.







